| Natureduca - Portal educativo de ciencia y cultura |

Física
ELECTRICIDAD
Estructura de la materia - 5ª parte
Valencia atómica
 os átomos bajo determinadas condiciones
pueden combinarse entre si para formar las numerosas y diferentes sustancias
conocidas hoy día. El número de electrones perdidos de la capa externa, si
estuviera completa, determina la valencia del átomo. Por lo tanto a la capa
externa se la denomina capa de valencia, y a los electrones de esta capa
electrones de valencia.
os átomos bajo determinadas condiciones
pueden combinarse entre si para formar las numerosas y diferentes sustancias
conocidas hoy día. El número de electrones perdidos de la capa externa, si
estuviera completa, determina la valencia del átomo. Por lo tanto a la capa
externa se la denomina capa de valencia, y a los electrones de esta capa
electrones de valencia.
Valencia positiva y negativa
Teóricamente la valencia de un átomo puede ser positiva o negativa. El sodio necesita 7 electrones para completar su capa exterior, tiene por lo tanto una valencia negativa de 7 ó positiva de 1. El cloro necesita un electrón para completar su capa exterior, por lo tanto tiene una valencia positiva de 7 ó negativa de 1.En la práctica los elementos tienden a tener una sola valencia, positiva o negativa, pero no ambas. Los metales generalmente tienen valencia positiva y los no metales negativa. El sodio, que es metal tiene una valencia atómica de +1 mientras que el cloro que no es metal tiene una valencia de -1. Algunos de los elementos pueden tener valencias positivas o negativas.
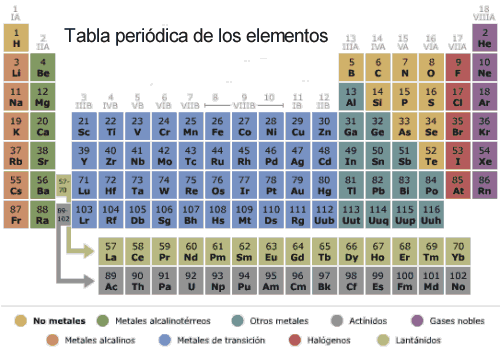
Clasificación de los elementos periódicos
Los elementos periódicos se clasificaron inicialmente en ocho grupos. Estos grupos también se les denominan familias porque todos tienen el mismo número de electrones de valencia en su capa externa. Así, todos los elementos del Grupo I tienen un electrón de valencia en su capa exterior. Los del grupo II tienen dos y así sucesivamente hasta el Grupo VIII, que tienen 8 electrones de valencia. Actualmente, se ha popularizado un sistema de clasificación en el que se enumeran los grupos de forma consecutiva del 1 al 18, con 7 filas llamadas periodos.Anteriormente, se incluían los gases inertes dentro del grupo 0, pues a pesar de que éstos contienen 8 electrones en su última capa y aparentemente debían figurar en el grupo VIII, se reflejaban en una columna independiente debido a una diferencia muy significativa en la penúltima capa de ambas clases de elementos. Esta penúltima capa en los gases inertes está completamente llena con el número máximo de electrones que puede contener. El argón por ejemplo, tiene 8 electrones en la capa L y 8 en la M. Sin embargo, el hierro tiene 8 electrones en la capa L, y solamente 8 en lugar de 18 en la M (los elementos que no son gases inertes no contienen el número máximo posible de electrones en todas sus capas). Actualmente los gases inertes se incluyen en el grupo 18.